Panoramica
Approfondimenti scientifici
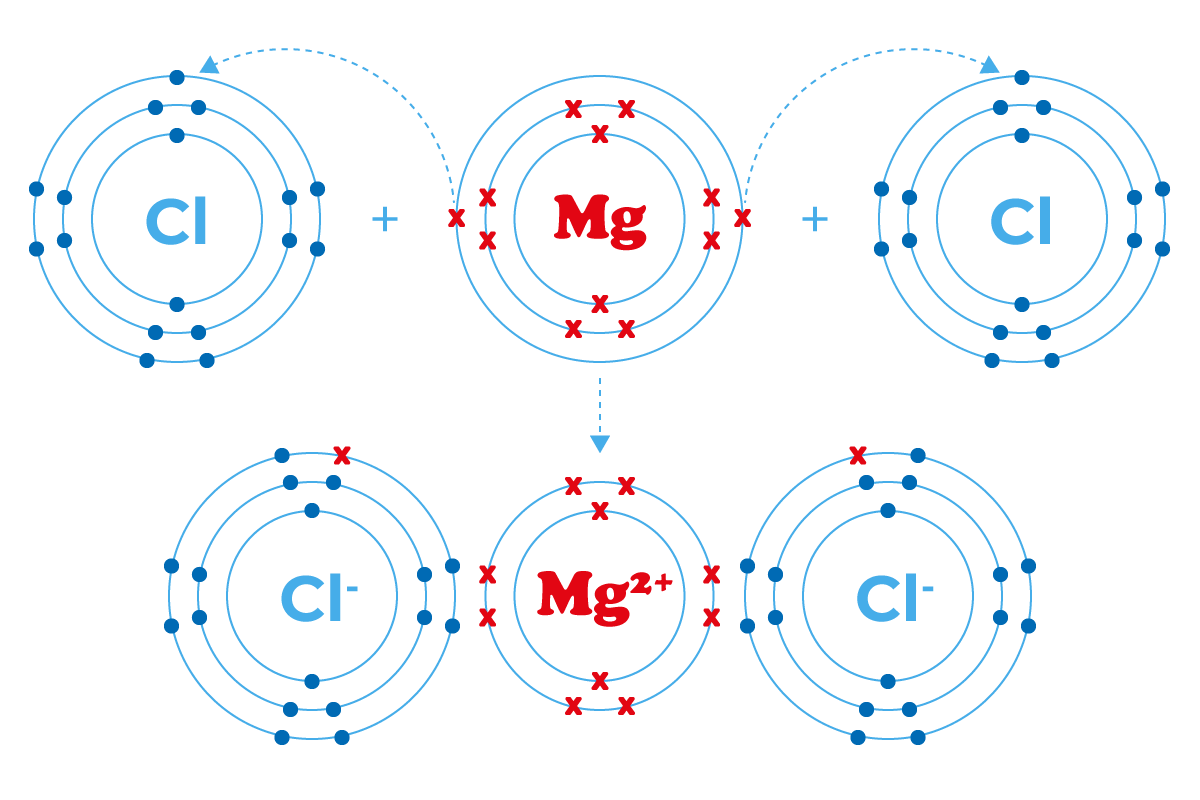
Il magnesio elemento
Il magnesio nella sua conformazione elettronica presenta due elettroni nell’orbitale più esterno. Questi vengono ceduti con facilità ad altri elementi chimici che necessitano di elettroni per completare il proprio livello energetico esterno esempi tipici sono il Cloro e l’Ossigeno.
I sali di magnesio
Il magnesio in natura si trova sotto forma di composti e sali di magnesio e come tale viene assunto sia con la dieta, sia con l’integrazione.
Tali sali sono classificati come organici o inorganici a seconda degli elementi che di volta in volta sono associati al Magnesio, e differiscono tra loro per le loro caratteristiche organolettiche, chimico fisiche (come la solubilità), per quantità di elemento Magnesio apportato in percentuale. Queste caratteristiche peculiari di ciascun sale influiscono sulla biodisponibilità del magnesio.
In generale i Sali inorganici di magnesio apportano in percentuale quantità maggiori di Mg++ ma presentano una solubilità scarsa. Al contrario i Sali organici presentano (in generale e con le dovute eccezioni) una migliore solubilità ma un minor apporto di magnesio elemento.
- % di Magnesio in alcuni sali
- sali inorganici
- sali organici
Il magnesio citrato è magnesio legato al citrato, grande molecola che viene facilmente trasportata nel tratto gastrointestinale. Si può ricavare dalla reazione di un sale di magnesio con l’acido citrico, con formazione di magnesio citrato per reazione stechiometrica. A livello gastrointestinale si dissocia, consentendo l’assorbimento più efficace ed efficiente del magnesio nel sangue. L’alta velocità di assorbimento e quindi biodisponibilità e la buona solubilità lo rendono efficace nell’integrazione di magnesio.
Il magnesio ossido è un sale di magnesio inorganico ed è una delle forme disponibili più scarsamente assorbite. La molecola è piccola e questo consente l’aggiunta di maggiori quantità di magnesio per dose, ma viene assorbita lentamente all’interno del tratto gastrointestinale e ha un effetto idrofilo nel colon, producendo un effetto lassativo.
Questa fonte di magnesio presenta, tra tutte le forme inorganiche, la migliore solubilità in acqua. Di conseguenza, come dimostrano diversi studi, presenta una buona velocità di assorbimento e quindi biodisponibilità, simile o comunque di poco inferiore ai sali organici. Ha però lo svantaggio di apportare oltre al magnesio, anche il cloro, non necessario all’organismo che potrebbe alterare l’equilibrio idrosalino e compromettere la funzionalità renale.
Nell’organismo umano il Magnesio viene assorbito principalmente nella prima parte dell’intestino. Una volta ingerito in forma di composto o sale, viene infatti trasformato in «Magnesio libero» ovvero in forma di «ione Mg++». In tale forma è assorbito e produce i noti effetti benefici.
Biodisponibilità dei Sali di magnesio
Come detto, il magnesio viene assorbito sempre come ione, indipendentemente dalla sua origine. Tuttavia, le caratteristiche peculiari di ciascun composto/sale di Magnesio, influiscono sulla sua solubilità, e sulla sua velocità di assorbimento.
La fonte da cui viene assunto il Magnesio fa quindi la differenza sull’assorbimento e in fine ultimo sull’effetto sull’organismo. Per la scelta della fonte di magnesio ottimale, risultano quindi fondamentali due aspetti:
- quantità di magnesio: scegliere un sale ricco in Magnesio
- velocità di assorbimento: Apportare un sale di magnesio con maggiore velocità di assorbimento che si traduce in maggiore biodisponibilità per l’organismo
I sali di Magnesio possono essere organici o inorganici ed apportano diversi quantitativi di Mg elemento.
Ad esempio, il Magnesio citrato ne contiene quasi il doppio (16%) rispetto al Magnesio pidolato (8,6%), mentre il Magnesio Carbonato è tra le fonti più ricche con 24 mg ogni 100 mg (24%). In genere i sali inorganici sono più ricchi in Magnesio rispetto ai sali organici, tuttavia sono meno biodisponibili. (1)(3)(4)(5)(6)
Come apportare la massima quantità di Magnesio garantendo il massimo assorbimento?
Scegliendo un sale di magnesio molto ricco in ione magnesio e trasformandolo in un sale solubile!
Più il sale è solubile, più velocemente e in quantità maggiore sarà assorbito. (2)(7)(8)
Il Magnesio carbonato è tra le fonti più ricche in Magnesio ma tra le meno solubili.
Questo, una volta combinato con acido citrico in presenza di acqua dà vita al Magnesio Citrato, uno dei sali organici con maggiore solubilità, centinaia di volte più solubile del carbonato!
Visita le altre sezioni

L'integratore a base di magnesio ideale per il benessere di tutta la famiglia.
- Firoz M et al. (2001). Bioavailability of US commercial magnesium preparations; Mag Res
- Knochel JP (1991). Disorders of magnesium metabolism; Har Princ Int Med
- Ranade VV et al. (2001). Bioavailability and pharmacokinetics of magnesium after administration of magnesium salts to humans; Am J Ther
- Rude RK (2010). Magnesium; Encyclopedia of Dietary Supplements. 2nd ed. New York, NY: Informa Healthcare
- Rylander R (2014). Bioavailability of Magnesium – A Review; J Pharm Nutr Sci
- Walker AF et al. (2003). Mg citrate found more bioavailable than other Mg preparations in a randomised, double-blind study; Mag Res
- White J et al. (1992). Blood and urinary magnesium kinects after oral magnesium supplementation; Clin Ther
- Workinger JL et al. (2018). Challenges in diagnosis of magnesium status – review; Nutrients
